Es el tipo de enlace más simple, el cual se encuentra en sales como el cloruro de sodio (NaCl). Es un enlace electroestático, donde la energía potencial electrostática Ue de los iones separados una distancia r es -ke²/r. Cuando la separación de los iones es menor que unos 0,95 nm, la energía potencial negativa de atracción es superior a los 1,52 eV necesarios para crear los iones. Por lo tanto, a distancias de separación inferiores a 0,95 nm es energéticamente favorable (es decir, la energía total del sistema se reduce) para el átomo de sodio el hecho de ceder un electrón al átomo de cloro y formar NaCl.
Cuando la atracción electrostática se incrementa cuando los iones se aproximan podríamos pensar que el equilibrio es imposible. Sin embargo, cuando la separación entre los iones es muy pequeña, se produce una fuerte repulsión de naturaleza mecánico-cuántica que está relacionada con el principio de exclusión. Este principio es responsable de la repulsión de los átomos en todas las moléculas en cualquier mecanismo de enlace. Cualitativamente se puede entender del modo siguiente. Cuando los iones están muy separados, la distribución de probabilidad de los electrones de capas centrales comienzas a solaparse; es decir, los electrones de ambos iones comienzan a ocupar la misma región del espacio. Debido al principio de exclusión, algunos de estos electrones deben pasar a estados cuánticos de energía superior. Sin embargo, para desplazar los electrones a estados cuánticos de mayor energía se requiere energía. Este incremento de energía cuando los iones son impulsados a reunirse es equivalente a la energía de repulsión entre ellos. No es un proceso súbito. Los estados energéticos de los electrones cambian gradualmente cuando los iones se aproximan entre sí. | Enlace Covalente
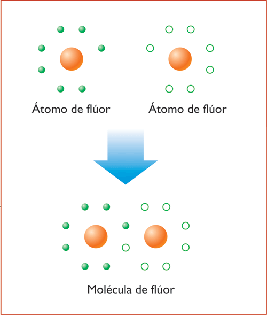
Un mecanismo completamente distinto, el enlace covalente, es el responsable del enlace de átomos idénticos o semejantes para formar moléculas. La atracción de los dos átomos que conforman una molécula es un efecto talmente mecánico -cuántico. La disminución de energía al aproximarse los dos tamos entre sí se debe a que los dos electrones son compartidos por ambos átomos.
Este proceso está íntimamente asociado a las propiedades de simetría de las funciones de onda de los electrones. Podemos hacernos una idea del enlace covalente considerando el problema simple de mecánica cuántica unidimensional formado por dos pozos rectangulares infinitos. Como los pozos son idénticos, la distribución de probabilidad, que es proporcional a ψ², debe ser simétrica, respecto a punto medio entre los pozos. La función de onda total de los dos electrones puede expresarse como el productor de un factor espacial y un factor espín. Por lo tanto, una función de onda anti simétrica puede ser el producto o bien de un factor espacial simétrico y un factor de espín anti simétrico, o bien de un factor de espín simétrico y un factor espacial anti simétrico. Para que la función de onda total de dos electrones sea anti simétrica, el factor espacial de la función de onda debe ser antismetrico para espines paralelos (s=1) y simétrico para espines antiparalelos (S=0). La energía potencial electroestática total de una molécula consta de energía positiva de repulsión entre los dos electrones y entre los dos protones,, más la energía potencial negativa de atracción cada electrón y cada protón.
autor:ignacio y sergio
|
La formación de iones Los iones pueden ser de dos tipos. Los cationes son iones positivos que se forman al perder electrones. Por ejemplo, un átomo de sodio pierde un electrón para convertirse en un catión sodio, \text{Na}^+ Na + start text, N, a, end text, start superscript, plus, end superscript . Los iones negativos se forman al ganar electrones y se llaman aniones . Los aniones reciben nombres que terminan en "-uro"; por ejemplo, el anión del cloro ( \text{Cl}^- Cl − start text, C, l, end text, start superscript, minus, end superscript ) se llama cloruro. Cuando un átomo pierde un electrón y otro átomo gana un electrón, el proceso se conoce como transferencia de electrones . Los átomos de sodio y de cloro son un buen ejemplo de transferencia de electrones. El sodio (Na) solo tiene un electrón en su capa electrónica externa, por lo que es más fácil (más electrónicamente estable) que el sodio done ese electrón a que encuentre siete electróne...
Comentarios
Publicar un comentario